Получена молекулярная структура бактериофага DT57C, поражающего кишечную палочку
Бесконтрольное использование антибиотиков в медицине, животноводстве и сельском хозяйстве привело к тому, что все больше бактерий приобретает устойчивость к этим веществам. Поэтому ученые стремятся найти новые технологии для борьбы с бактериальными заболеваниями человека, животных и растений. Одно из перспективных решений — использование бактериофагов — вирусов, специфично поражающих определенные виды бактерий. Чтобы адаптировать фаговую терапию для борьбы с опасными патогенами, нужно в подробностях знать строение таких вирусов.
Ученые из России (ФИЦ Биотехнологии РАН, МГУ имени М.В. Ломоносова) с коллегами из Японии и Китая описали молекулярное строение бактериофага DT57C, поражающего кишечную палочку (Escherichia coli) — бактерию, которая может вызывать у человека крайне разнообразные патологии от кишечных заболеваний до урологических инфекций и пневмоний. В ходе исследования авторы использовали метод криоэлектронной микроскопии и молекулярное моделирование, позволяющие определить трехмерную структуру белков на уровне отдельных атомов.
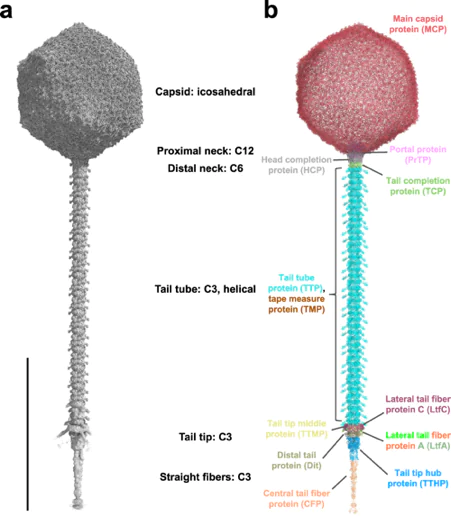
Исследователи выяснили, что капсид бактериофага DT57C — белковая оболочка, в которую «упакована» генетическая информация, — имеет распространенную для других вирусов форму икосаэдра, или двадцатигранника. При этом в состав оболочки входит два белка — основной капсидный белок MCP и вспомогательный, так называемый «декоративный» белок DCP. Каждая грань оболочки c включает 6 гексамеров главного белка капсида, в центре каждого из которых располагается декорирующий белок.
Бактериофаги, помимо капсида, имеют хвостовой отросток или просто хвост — структуру, которая обеспечивает прикрепление к бактериальной клетке и «впрыскивание» в нее молекулы нуклеиновой кислоты (ДНК или РНК). У фага DT57C хвост представляет собой белковую трубку, на одном конце которой имеется переходный комплекс для соединения с капсидом, так называемая шейка фага, а на другом – базальная структура или tip-комплекс, отвечающий за распознавание поверхности клетки хозяина. Исследователям удалось частично визуализировать структуру белка TMP, расположенного внутри канала хвоста. Этот белок играет важную роль как при сборке хвоста в клетке бактерии, так и в процессе инфицирования новой клетки хозяина. В этой работе удалось показать, что и верхняя (со стороны головки) и нижняя часть тяжа TMP представленна трехтяжевой косичкой из альфа-спиралей (трехтяжевой coiled coil структурой). Очень необычным по сравнению с другими фагами оказался и способ присоединения боковых фибрилл хвоста.
«Наши реконструкции позволили выявить нетипичный способ прикрепления боковых хвостовых нитей к хвостовому отростку. Оказалось, что этому способствует специальное кольцо из 12 субъединиц небольшого белка LtfC, в который под углом в 120 градусов заходят своими N-концевыми фрагментами тримеры белка LtfA, формирующего собственно фибриллы. Второй белок фибрилл LtfB присоединяется уже к LtfA. При образовании структуры, закрепляющей LtfA на хвосте фага, белковые цепи LtfA и LtfC сложным образом переплетаются, образуя совместные бета-листки, так что все кольцо с тремы исходящими из него фибриллами представляет единое целое. Кроме этого, мы смогли проанализировать вирусные частицы, когда их капсиды содержали ДНК, и когда нуклеиновая кислота была уже "выброшена". Благодаря этому мы смогли построить атомные модели обоих состояний и понять конформационные изменения, приводящие к высвобождению ДНК», — рассказывает Андрей Летаров, доктор биологических наук, заведующий лабораторией вирусов микроорганизмов ФИЦ Биотехнологии РАН.
Результаты исследования опубликованы в журнале Nature Communications.



